Latihan Soal Saintek UTBK 2022: Kimia

UTBK semakin dekat. Persiapkan dirimu dengan latihan soal dan pembahasan UTBK Kimia 2022 berikut ini!
—

Topik: Asam Basa
Sub Topik: Teori Asam Basa
1. Pada reaksi berikut
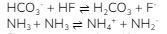
Senyawa yang bersifat asam menurut Bronsted–Lowry adalah…
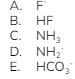
Kunci: B
Pembahasan:
Asam menurut teori asam basa Bronsted–Lowry adalah spesi yang mendonorkan proton (H+). Asam dan basa konjugasi hanya berbeda pada jumlah satu atom H nya saja. Asam Bronsted-Lowry memiliki satu atom H lebih banyak dibandingkan basa konjugasinya. Jadi, spesi yang termasuk asam adalah HF dengan basa konjugasinya adalah F–. NH3 dalam hal ini juga merupakan asam, tetapi dia juga sekaligus basa karena dalam reaksinya, NH3 berubah menjadi NH4+ dan NH2–.

Topik: Asam Basa
Sub Topik: Perhitungan Asam Basa
2. Magnesium hidroksida terdapat pada obat maag dengan  Bila 4 tablet obat maag (tiap tablet mengandung
Bila 4 tablet obat maag (tiap tablet mengandung 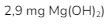 dilarutkan dalam 200 mL air, pH larutan diperkirakan akan menjadi …
dilarutkan dalam 200 mL air, pH larutan diperkirakan akan menjadi … 
- 10
- 5 + log2
- 4
- 11 + log2
- 9 – log 2
Kunci: A
Pembahasan:
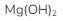 merupakan basa lemah bervalensi 2. Karena
merupakan basa lemah bervalensi 2. Karena ![]() dari
dari 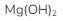 sangat kecil dan jauh dari
sangat kecil dan jauh dari ![]() ion hidroksida dari hasil disosiasi kedua
ion hidroksida dari hasil disosiasi kedua 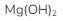 bisa diabaikan saja, sehingga rumus yang digunakan adalah:
bisa diabaikan saja, sehingga rumus yang digunakan adalah:
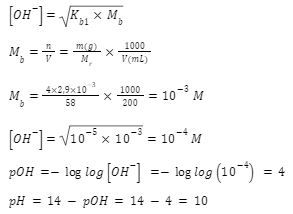

Topik: Asam Basa
Sub Topik: Larutan Penyangga Basa
3. Untuk memperoleh larutan dengan 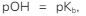 volume larutan HCl 0,1 M yang harus ditambahkan ke dalam 100 mL larutan metilamina
volume larutan HCl 0,1 M yang harus ditambahkan ke dalam 100 mL larutan metilamina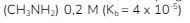 adalah..
adalah..
- 20 mL
- 40 mL
- 50 mL
- 100 mL
- 200 mL
Kunci: D
Pembahasan:
Dalam hal ini, basa lemah ditambahkan dengan asam kuat hingga pH tertentu. Ada kemungkinan tiga skema dari pencampuran ini:
- Buffer basa (bila jumlah basa lemah > jumlah asam kuat)
- Hidrolisis garam asam (bila jumlah basa lemah = jumlah asam kuat)
- Sisa asam kuat (bila jumlah basa lemah < jumlah asam kuat)
Kasus 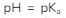 maupun
maupun 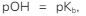 akan kita temui pada kondisi buffer. Oleh karenanya, kondisi yang diminta soal adalah kondisi buffer, sehingga rumus yang digunakan adalah:
akan kita temui pada kondisi buffer. Oleh karenanya, kondisi yang diminta soal adalah kondisi buffer, sehingga rumus yang digunakan adalah:
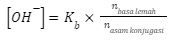
Agar terbentuk 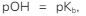 maka
maka  atau dengan kata lain
atau dengan kata lain
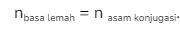




Topik: Asam Basa
Sub Topik: Larutan Penyangga Asam
4. Sebanyak 200 mL larutan NaOH dicampurkan dengan 600 mL larutan 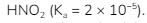 Kedua larutan itu memiliki konsentrasi yang sama. pH larutan yang terbentuk adalah… (log2 = 0,3)
Kedua larutan itu memiliki konsentrasi yang sama. pH larutan yang terbentuk adalah… (log2 = 0,3)
- 4,4
- 4,7
- 9,6
- 9
- 9,3
Kunci: A
Pembahasan:
Konsentrasi  sama sehingga untuk memudahkan, diasumsikan 1 M.
sama sehingga untuk memudahkan, diasumsikan 1 M.
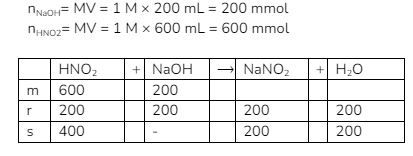
Kondisi: Asam lemah + basa kuat, jumlah asam lemah > jumlah basa kuat
Karena sisa asam lemah, campuran mengikuti skema buffer asam, sehingga rumus yang digunakan adalah:
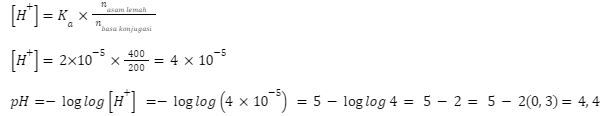

Topik: Asam Basa
Sub Topik: Hidrolisis Garam Basa
5. Asam asetat (CH3COOH) adalah asam lemah dengan Ka = 10-5. Perbandingan [CH3COOH] dan [CH3COO–] dalam larutan CH3COOK pada pH= 8 adalah …
- 0,01
- 0,1
- 10
- 0,001
- 1
Kunci: D
Pembahasan:
Larutan CH3COOK merupakan larutan garam basa yang terdiri dari asam lemah CH3COOH dan basa kuat KOH. Oleh karenanya, dia mengalami hidrolisis sebagian. Ion yang terhidrolisis adalah CH3COO–, seperti pada reaksi:

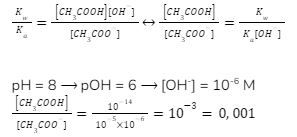

Topik: Asam Basa
Sub Topik: Hidrolisis Garam Asam
6. Ke dalam 200 mL larutan HCl 0,10 M ditambahkan 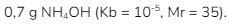 Larutan yang dihasilkan memiliki pH …
Larutan yang dihasilkan memiliki pH …
- 4
- 10
- 5
- 9
- 8
Kunci: C
Pembahasan:
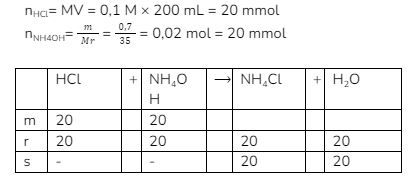
Kondisi: Basa lemah + asam kuat, jumlah basa lemah = jumlah asam kuat, sehingga masuk hidrolisis garam asam.
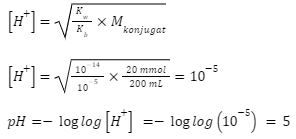

Topik: Asam Basa
Sub Topik: Titrasi Asam Basa
7. Asam oksalat adalah asam berbasa dua. Sebanyak 10 mL larutan asam oksalat diencerkan dengan air sampai volumenya 100 mL. Larutan ini digunakan untuk menitrasi 20 mL larutan NaOH 0,2 M dengan indikator bromtimol biru. Bila titik akhir titrasi diperoleh saat volume asam oksalat mencapai 50 mL, maka konsentrasi larutan asam oksalat awal adalah …
- 0,08 M
- 0,40 M
- 0,80 M
- 1,60 M
- 3,20 M
Kunci: B
Pembahasan:
Untuk mencari konsentrasi pada saat titrasi bisa digunakan rumus:
(Jangan lupa a asam oksalat 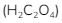 adalah 2)
adalah 2)
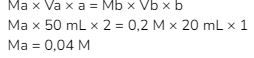
Konsentrasi yang diminta soal adalah konsentrasi awal (sebelum pengenceran), sedangkan yang dicari baru konsentrasi yang digunakan saat titrasi (setelah pengenceran). Oleh karenanya, untuk mencari konsentrasi awal digunakan rumus pengenceran:
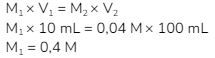

Topik: Kelarutan dan Hasil Kali Kelarutan
Sub Topik: Hasil Kali Kelarutan
8. Pada temperatur tertentu 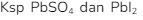 berturut – turut adalah
berturut – turut adalah  Pada temperatur tersebut..
Pada temperatur tersebut..
- Kelarutan kedua zat tidak bisa dibandingkan, karena berbeda jumlah ionnya
- Kelarutan kedua zat tidak bisa dibandingkan, karena berbeda anion
- Kelarutan
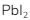 sama dengan kelarutan
sama dengan kelarutan 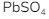
- Kelarutan
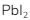 lebih besar daripada kelarutan
lebih besar daripada kelarutan 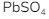
- Kelarutan
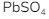 lebih besar daripada kelarutan
lebih besar daripada kelarutan 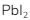
Kunci: D
Pembahasan:
Menentukan kelarutan ![]()
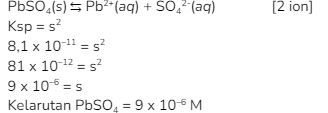
Menentukan kelarutan ![]()
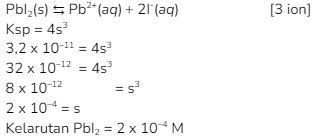
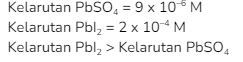

Topik: Kelarutan dan Hasil Kali Kelarutan
Sub Topik: Kelarutan
9. Jika diketahui Ksp 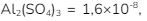 maka kelarutan
maka kelarutan 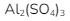 dalam 1 L larutan asam sulfat yang pHnya 1-log2 adalah …
dalam 1 L larutan asam sulfat yang pHnya 1-log2 adalah …

Kunci: D
Pembahasan:



Topik: Kelarutan dan Hasil Kali Kelarutan
Sub Topik: Faktor-Faktor yang Mempengaruhi Kelarutan
10. Kelarutan![]() dalam air sama dengan kelarutan
dalam air sama dengan kelarutan ![]() dalam air panas
dalam air panas
SEBAB
Kelarutan suatu garam hanya berubah jika ada pemanasan
- Pernyataan benar, sebab benar dan saling berhubungan
- Pernyataan benar, sebab benar, tetapi tidak berhubungan
- Pernyataan benar, sebab salah
- Pernyataan salah, sebab benar
- Pernyataan salah, sebab salah
Kunci: E
Pembahasan:
Pernyataan pertama salah.
Kelarutan 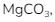 lebih besar pada air panas dari pada air biasa. Ini disebabkan karena
lebih besar pada air panas dari pada air biasa. Ini disebabkan karena ![]() bergantung pada faktor suhu. Umumnya Ketika suhu dinaikkan,
bergantung pada faktor suhu. Umumnya Ketika suhu dinaikkan, ![]() akan meningkat, sehingga lebih banyak
akan meningkat, sehingga lebih banyak ![]() yang larut.
yang larut.
Pernyataan kedua salah.
Kelarutan garam dapat berubah karena faktor ion senama, suhu, pH dan pengadukan.

Masih kurang? Wah, kamu wajib coba paket UTBK Brain Academy sih. Tryout-nya sampai 23 kali loh! Ada modul belajar, rasionalisasi SNMPTN, sesi konsultasi via google meet atau chat, tes minat bakat, kelas pengembangan diri, laporan perkembangan belajar, ribuan latihan soal, dan masih banyak fitur lain yang bantu kamu masuk PTN favorit.
Tim Penyusun:
- Moch. Akbar Reno Marsasi
- Berlian Belia Basuki
![[IDN] CTA Blog Brain Academy](https://cdn-web.ruangguru.com/landing-pages/assets/cta/49210bfe-c949-4567-b773-0cd0fe4aa1f4.jpeg)









